Металлы в периодической таблице
Все элементы в периодической системе Дмитрия Менделеева делятся на две большие группы: металлы и неметаллы. Первая является самой многочисленной. Большинство элементов — металлы (синий). Неметаллы в таблице изображены на желтом фоне. Есть также группа элементов, которые относят к металлоидам (красный). Все металлы сгруппированы в левой части таблицы. Обратите внимание, что водород сгруппирован с металлами в верхнем левом углу. Несмотря на это, он считается неметаллическим. Однако некоторые ученые теоретизируют, что в ядре планеты Юпитер может быть металлический водород.
Классификация
Из 118 химических элементов, открытых на данный момент, к металлам относят:
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr;
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra;
а также вне определённых групп бериллий и магний;
40 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn; — Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd; — La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg; — Ac, Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi;
7 в группе полуметаллов[1]: B, Si, Ge, As, Sb, Te, Po;
14 в группе лантаноиды + лантан (La): Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu;
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac): Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Также металлическими свойствами может обладать водород[2][3].
Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность)
.
Кроме того, в физике металлам, как проводникам, противопоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника)
)[4].
Некоторые группы/семейства металлов
Осмий

Алюминий

Барий
- Щелочные:
- Литий
- Натрий
- Калий
- Рубидий
- Цезий
- Франций
- Щёлочноземельные:
- Кальций
- Стронций
- Барий
- Радий
- Другие (которые зачастую не совсем правильно относят к щёлочноземельным):
- Бериллий
- Магний
- Переходные:
- Уран
- Титан
- Железо
- Платина
- Медь
- Цинк
- Золото
- Серебро
- Палладий
- Ртуть
- Никель
- Кобальт
- Вольфрам
- Постпереходные:
- Лёгкие: Алюминий
- Галлий
- Свинец
- Олово
- Тяжёлые:
- Свинец
- Ртуть
- Медь
- Кадмий
- Кобальт
- Тугоплавкие
- Металлы платиновой группы
- Цветные
- Благородные
- Монетные
Аморфные металлы
Основная статья: Аморфные металлы
Металлическое связывание
Многие из замечательных и полезных качеств элемента связаны с тем, как его атомы соединяются друг с другом. При этом возникают определенные связи. Металлическое взаимодействие атомов приводит к созданию металлических структур. Любой образец этого элемента в повседневной жизни, от автомобиля до монет в кармане, включает в себя металлическое соединение.

Во время этого процесса атомы металла разделяют свои внешние электроны равномерно друг с другом. Электроны, протекающие между положительно заряженными ионами, легко передают тепло и электроэнергию, делая эти элементы такими хорошими проводниками тепла и электричества. Медные провода используются для электроснабжения.

Структура металлов
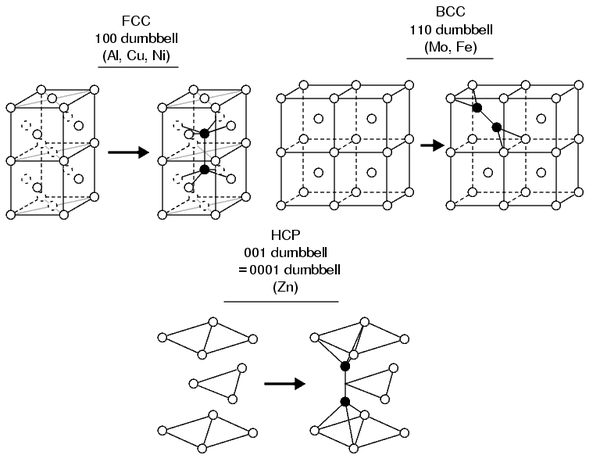
Кристаллическая структура сплавов
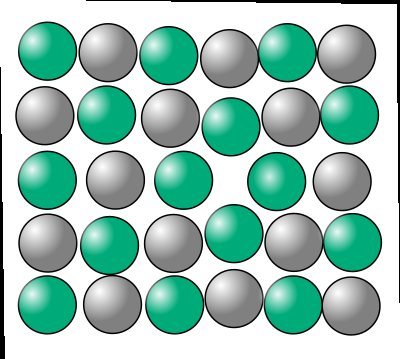
Вакансия в кристаллической решётке Образование дендритов
См. также: Металловедение
Ни один металл невозможно приготовить в абсолютно чистом состоянии. Технически «чистые» металлы могут содержать до нескольких процентов примесей, и если эти примеси являются элементами с низким атомным весом (например, углерод, азот или кислород), то в пересчёте на атомные проценты содержание этих примесей может быть очень большим. Первые небольшие количества примесей в металле обычно входят в кристалл в виде твёрдого раствора. Можно выделить два главных типа твёрдых растворов:
- первый, когда атомы примеси намного меньше атомов металла-растворителя, растворённые атомы располагаются в решётке растворителя по междоузлиям, или «пустотам». Образование таких твёрдых растворов — твёрдых растворов внедрения — почти всегда сопровождается расширением решётки растворителя, и в окрестности каждого растворённого атома имеется локальное искажение решётки;
- второй, когда атомы примеси и растворителя имеют приблизительно одинаковые размеры, образуется твёрдый раствор замещения, в котором атомы растворённого элемента замещают атомы растворителя, так что атомы обоих сортов занимают места в узлах общей решётки. В таких случаях тоже вокруг каждого растворённого атома имеется искажённая область, а будет ли при этом решётка расширяться или сжиматься, зависит от относительных размеров атомов растворителя и растворённого вещества[11].
Для большей части металлов наиболее важными элементами, образующими твёрдые растворы внедрения, являются водород, бор, углерод, азот и кислород. Присутствие дислокаций всегда приводит к появлению аномально больших или малых межатомных расстояний. В присутствии примесей каждая дислокация окружена «атмосферой» примесных атомов. Примесные а дислокации, потому что в результате перемещения дислокаций будет образовываться новая конфигурация с повышенной энергией. Границы между кристаллами также являются областями с аномальными межатомными расстояниями и, следовательно, тоже растворяют примесные атомы легче, чем неискажённые области кристаллов.
При увеличении содержания примесей растворённые атомы входят и в основную массу кристалла, однако всё ещё имеется избыток примеси по границам зёрен и вокруг дислокаций. Когда содержание примеси превышает предел растворимости, появляется новая фаза, которая может представлять собой или растворённое вещество, или промежуточную фазу, или соединение. В таких случаях границы между фазами могут быть двух родов. В общем случае кристаллическая структура частичек примеси слишком отлична от структуры металла-растворителя, поэтому решётки двух фаз не могут переходить одна в другую, образуя непрерывную структуру. В таких случаях на границах раздела фаз образуются слои с нерегулярной (искажённой) структурой. С образованием границ связано появление свободной поверхностной энергии, однако энергия деформации решётки растворителя относительно невелика. В таких случаях говорят, что эти частицы выделяются некогерентно.
B ряде случаев межатомные расстояния и кристаллическая структура металла-растворителя и частичек примеси таковы, что некоторые плоскости могут соединяться между собой, образуя непрерывную структуру. Тогда говорят, что частицы второй фазы выделяются когерентно и, поскольку сопряжение решёток никогда не бывает абсолютно точным, вокруг границы образуется сильно напряжённая область. В тех случаях, когда энергия деформации слишком велика для этого, соседние кристаллы могут контактировать таким образом, что при этом в пограничных слоях возникают области упругой деформации, а на самой границе раздела — дислокации. В таких случаях говорят, что частицы выделяются полукогерентно[12].
При повышении температуры вследствие увеличения амплитуды колебаний атомов может образоваться дефект кристаллической решётки, который называют вакансия или «дырка». Диффузия вакансий является одним из механизмов образования дислокаций[13].
Как правило, кристаллизация металла происходит путём переохлаждения с образованием дендритной структуры. По мере разрастания дендритные кристаллы соприкасаются, при этом образуются различные дефекты структуры. В большинстве случаев металл затвердевает так, что первая порция кристаллов содержит меньше примесей, чем последующие. Поэтому, как правило, примеси концентрируются на границах зёрен, образуя стабильные структуры[14].
Реакции металлов
Реакционная способность относится к тенденции элемента реагировать с химическими веществами в его окружении. Она бывает разная. Некоторые металлы, например, калий и натрий (в колонках 1 и 2 в периодической таблице), легко реагируют со многими различными химическими веществами и редко встречаются в своей чистой, элементарной форме. Оба обычно существуют только в соединениях (связанных с одним или несколькими другими элементами) или как ионы (заряженная версия их элементарной формы).

С другой стороны, существуют и другие металлы, их еще называют ювелирными. Золото, серебро и платина являются не очень реактивными и обычно встречаются в чистом виде. Эти металлы легче теряют электроны, чем неметаллы, но не так легко, как реактивные металлы, например, натрий. Платина относительно нереакционноспособна и очень устойчива к реакциям с кислородом.
Периодическая система Менделеева
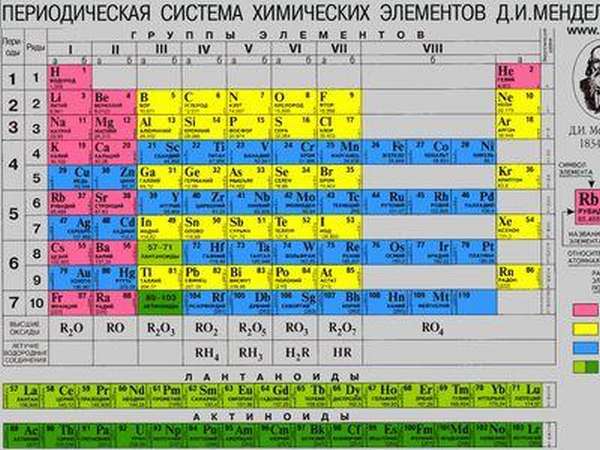
Периодическая таблица химических элементов была составлена Д. И. Менделеевым во второй половине XIX века. Что такое это, и для чего она нужна? Она объединяет все химические элементы по возрастанию атомного веса, причем, все они расставлены так, что их свойства изменяются периодическим образом.
Периодическая система Менделеева в химии свела в единую систему все существующие элементы, прежде считавшиеся просто отдельными веществами.
На основании ее изучения были предсказаны, а впоследствии — синтезированы новые химические вещества. Значение этого открытия для науки невозможно переоценить, оно значительно опередило свое время и дало толчок к развитию химии на многие десятилетия.
Существует три наиболее распространенных варианта таблицы, которые условно именуются «короткая», «длинная» и «сверхдлинная». Основной считается длинная таблица, она утверждена официально. Отличием между ними является компоновка элементов и длина периодов.
Что такое период
Система содержит 7 периодов. Они представлены графически в виде горизонтальных строк. При этом, период может иметь одну или две строки, называемые рядами. Каждый последующий элемент отличается от предыдущего возрастанием заряда ядра (количества электронов) на единицу.
Если не усложнять, период — это горизонтальная строка периодической таблицы. Каждый из них начинается металлом и заканчивается инертным газом. Собственно, это и создает периодичность — свойства элементов изменяются внутри одного периода, вновь повторяясь в следующем. Первый, второй и третий периоды — неполные, они называются малыми и содержат соответственно 2, 8 и 8 элементов. Остальные — полные, они имеют по 18 элементов.
Что такое группа
Группа — это вертикальный столбец, содержащий элементы с одинаковым электронным строением или, говоря проще, с одинаковой высшей валентностью. Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Каждая группа имеет свое название, облегчающее поиск или классификацию элементов. Усиливаются металлические свойства в независимости от элемента по направлению сверху-вниз. Это связано с увеличением количества атомных орбит чем их больше, тем слабее электронные связи, что делает более ярко выраженной кристаллическую решетку.
Свойства элементов
Когда вы изучали алфавит в начальной школе, вы обнаружили, что все буквы имеют свой собственный уникальный набор свойств. Например, у некоторых были прямые линии, у некоторых — кривые, а у других были линии обоих типов. То же самое можно сказать и об элементах. Каждый из них имеет уникальный набор физических и химических свойств. Физические свойства — это качества, присущие определенным веществам. Блестящий или нет, насколько он хорошо проводит тепло и электричество, при какой температуре тает, насколько большую имеет плотность.

Химические свойства включают те качества, которые наблюдаются при реагировании на воздействие кислородом, если они будут гореть (то, насколько сложно им будет удерживать их электроны во время химической реакции). Различные элементы могут иметь общие свойства. Например, железо и медь являются одновременно элементами, которые проводят электричество. Однако они не имеют одинаковых свойств. Например, когда железо подвергается воздействию влажного воздуха, оно покрывается ржавчиной, но когда медь оказывается под действием тех же условий, она приобретает специфический зеленый налет. Вот почему статуя Свободы зеленая, а не ржавая. Она сделана из меди, а не железа).

Взаимодействие кислот с металлами
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
M g + 2 H C l = M g C l 2 + H 2 ↑ {\displaystyle {\mathsf {Mg+2HCl=MgCl_{2}+H_{2}\uparrow }}} 2 A l + 2 H 3 P O 4 = 2 A l P O 4 + 3 H 2 ↑ {\displaystyle {\mathsf {2Al+2H_{3}PO_{4}=2AlPO_{4}+3H_{2}\uparrow }}}
Взаимодействие концентрированной серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
C u + 2 H 2 S O 4 = C u S O 4 + S O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Cu+2H_{2}SO_{4}=CuSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
Сильно разбавленная кислота реагирует с металлом по классической схеме:
M g + H 2 S O 4 = M g S O 4 + H 2 ↑ {\displaystyle {\mathsf {Mg+H_{2}SO_{4}=MgSO_{4}+H_{2}\uparrow }}}
При увеличении концентрации кислоты образуются различные продукты:
M g + 2 H 2 S O 4 = M g S O 4 + S O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Mg+2H_{2}SO_{4}=MgSO_{4}+SO_{2}\uparrow +2H_{2}O}}} 3 M g + 4 H 2 S O 4 = 3 M g S O 4 + S ↓ + 4 H 2 O {\displaystyle {\mathsf {3Mg+4H_{2}SO_{4}=3MgSO_{4}+S\downarrow +4H_{2}O}}} 4 M g + 5 H 2 S O 4 = 4 M g S O 4 + H 2 S ↑ + 4 H 2 O {\displaystyle {\mathsf {4Mg+5H_{2}SO_{4}=4MgSO_{4}+H_{2}S\uparrow +4H_{2}O}}}
Реакции для азотной кислоты (HNO3)

Продукты взаимодействия железа с HNO3 разной концентрации C u + 4 H N O 3 ( 60 % ) = C u ( N O 3 ) 2 + 2 N O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Cu+4HNO_{3}(60\%)=Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}} 3 C u + 8 H N O 3 ( 30 % ) = 3 C u ( N O 3 ) 2 + 2 N O ↑ + 4 H 2 O {\displaystyle {\mathsf {3Cu+8HNO_{3}(30\%)=3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
При взаимодействии с активными металлами вариантов реакций ещё больше:
Z n + 4 H N O 3 ( 60 % ) = Z n ( N O 3 ) 2 + 2 N O 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {Zn+4HNO_{3}(60\%)=Zn(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}} 3 Z n + 8 H N O 3 ( 30 % ) = 3 Z n ( N O 3 ) 2 + 2 N O ↑ + 4 H 2 O {\displaystyle {\mathsf {3Zn+8HNO_{3}(30\%)=3Zn(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}} 4 Z n + 10 H N O 3 ( 20 % ) = 4 Z n ( N O 3 ) 2 + N 2 O ↑ + 5 H 2 O {\displaystyle {\mathsf {4Zn+10HNO_{3}(20\%)=4Zn(NO_{3})_{2}+N_{2}O\uparrow +5H_{2}O}}} 5 Z n + 12 H N O 3 ( 10 % ) = 5 Z n ( N O 3 ) 2 + N 2 ↑ + 6 H 2 O {\displaystyle {\mathsf {5Zn+12HNO_{3}(10\%)=5Zn(NO_{3})_{2}+N_{2}\uparrow +6H_{2}O}}} 4 Z n + 10 H N O 3 ( 3 % ) = 4 Z n ( N O 3 ) 2 + N H 4 N O 3 + 3 H 2 O {\displaystyle {\mathsf {4Zn+10HNO_{3}(3\%)=4Zn(NO_{3})_{2}+NH_{4}NO_{3}+3H_{2}O}}}
Легирование
Основная статья: Легирование (металлургия)
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.
Организация элементов: металлы и неметаллы
Тот факт, что элементы имеют некоторые общие и уникальные свойства, позволяет сортировать их в красивую, аккуратную диаграмму, которая называется периодической таблицей. Она организует элементы на основе их атомного числа и свойств. Итак, в периодической таблице мы находим элементы, сгруппированные вместе, которые имеют общие свойства. Железо и медь находятся близко друг к другу, оба являются металлами. Железо обозначено символом «Fe», а медь обозначается символом «Cu».

Большинство элементов периодической таблицы — это металлы, и они, как правило, находятся в левой части таблицы. Они группируются вместе, потому что обладают определенными физическими и химическими свойствами. Например, металлы плотные, блестящие, они хорошие проводники тепла и электричества, и они легко теряют электроны в химических реакциях. Напротив, неметаллы имеют противоположные свойства. Они не плотные, не проводят тепло и электричество, и стремятся получить электроны, а не отдать их. Когда мы смотрим в периодическую таблицу, мы видим, что большинство неметаллов сгруппированы справа. Это такие элементы, как гелий, углерод, азот и кислород.

Применение
Люди научились применять металлы практически во всех сферах своей жизни. Из них делают конструкционные материалы, провода, электротехнику, посуду. Неустойчивые радиоактивные элементы, такие как уран, калифорний, полоний, нашли применение в ядерной энергетике и производстве оружия.
Легкие и прочные металлы используют в космической технике и автомобилестроении. Различные элементы применяются в фармацевтике, пищевой, текстильной промышленности. Из них делают украшения, предметы быта, а также лекарства и медицинские инструменты. Литий, например, используется как антидепрессант, золото входит в средства против артрита и туберкулеза. Титан и тантал используют в хирургии для протезов и замены поврежденных частей организма.
Что такое тяжелые металлы?
Список металлов достаточно многочисленный. Некоторые из них могут накапливаться в организме и не наносить ему при этом вреда, как например, природный стронций (формула Sr), который является аналогом кальция, так как продуктивно откладывается в костной ткани. Какие из них называются тяжелыми и почему? Рассмотрим четыре примера: свинец, медь, ртуть и мышьяк.
Где находятся эти элементы и как они влияют на окружающую среду и здоровье человека? Тяжелые металлы представляют собой металлические, встречающиеся в природе соединения, которые имеют очень высокую плотность по сравнению с другими металлами — по меньшей мере, они в пять раз больше плотности воды. Они токсичны для людей. Даже небольшие дозы могут привести к серьезным последствиям.

- Свинец. Это тяжелый металл, являющийся токсичным для людей, особенно для детей. Отравление этим веществом может привести к проблемам неврологического характера. Несмотря на то что когда-то он был весьма привлекательным из-за его гибкости, высокой плотности и способности поглощать вредное излучение, свинец был выведен из употребления по многим направлениям. Этот мягкий серебристый металл, который встречается на Земле, является опасным для людей и накапливается в организме в течение долгого времени. Самое страшное, что от него нельзя избавиться. Он сидит там, накапливается и постепенно отравляет тело. Свинец токсичен для нервной системы и может вызвать серьезное повреждение головного мозга у детей. Он широко использовался в 1800-х годах для создания макияжа и вплоть до 1978 года использовался в качестве одного из ингридиентов в краске для волос. Сегодня свинец используется в основном в больших батареях, в качестве экранов для рентгеновских лучей или изоляции для радиоактивного материала.
- Медь. Это красновато-коричневый тяжелый металл, у которого есть множество применений. Медь по-прежнему является одним из лучших проводников электричества и тепла, и многие электрические провода сделаны из этого металла и покрыты пластиком. Монеты, в основном мелочь, также делают из этого элемента периодической системы. Острые отравления медью встречаются редко, но, как и свинец, она может накапливаться в тканях, что в конечном итоге приводит к токсичности. Люди, которые подвергаются воздействию большим количеством меди или медной пыли, также находятся в зоне риска.
- Ртуть. Этот металл токсичен в любой форме и может даже поглощаться кожей. Его уникальность состоит в том, что он является жидким при комнатной температуре, его иногда называют «быстрым серебром». Его можно увидеть в термометре, потому что в качестве жидкости он поглощает тепло, изменяя объем даже с малейшей разницей в температуре. Это позволяет ртути подниматься или падать в стеклянной трубке. Поскольку это вещество является мощным нейротоксином, многие компании переходят на спиртовые термометры, окрашенные в красный цвет.
- Мышьяк. Со времен Римской империи вплоть до викторианской эпохи мышьяк считался «королем ядов», а также «ядом царей». История пронизана бесчисленными примерами как королевских лиц, так и простых людей, совершающих убийства для личной выгоды, используя соединения мышьяка, у которых не было ни запаха, ни цвета, ни вкуса. Несмотря на все отрицательные влияния, этот металлоид также имеет свои области применения, даже в медицине. Например, триоксид мышьяка является очень эффективным препаратом, используемым для лечения людей с острым промиелоцитарным лейкозом.
Производство металлов
Подготовка руды
Основные статьи: Руда
,
Добыча полезных ископаемых
,
Обогащение руд
,
Металлургия
,
Металловедение
Металлы извлекают из земли в процессе добычи полезных ископаемых. Добытые руды служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд в земной коре используются специальные поисковые методы, включающие разведку и исследование рудных месторождений. Месторождения руд разрабатываются открытым или карьерным способом и подземным или шахтным способом. Иногда применяется комбинированный (открыто-подземный) способ разработки рудных месторождений.
После извлечения руд они, как правило, подвергаются обогащению. При этом из исходного минерального сырья выделяют один или несколько полезных компонентов — рудный концентрат(ы), промпродукты и отвальные хвосты. В процессах обогащения используют отличия минералов полезного компонента и пустой породы в плотности, магнитной восприимчивости, смачиваемости, электропроводности, крупности, форме зёрен, химических свойствах и др.
Работа с рудой
Из добытой и обогащённой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространённые металлы, такие как железо, медь, олово, плавят с использованием углерода в качестве восстановителя. Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.[8][9]
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Что такое драгоценный металл?
Драгоценный металл представляет собой металл, который может быть редким или трудно добываемым, а также экономически очень ценным. Каков список металлов, являющихся драгоценными? Всего их три:
- Платина. Несмотря на свою тугоплавкость, она используется в ювелирных изделиях, электронике, автомобилях, в химических процессах и даже в медицине.
- Золото. Этот драгоценный металл используется для изготовления ювелирных изделий и золотых монет. Однако он имеет много других применений. Он используется в медицине, производстве и лабораторном оборудовании.
- Серебро. Этот благородный металл серебристо-белого цвета является очень ковким. в чистом виде является достаточно тяжелым, оно легче свинца, но тяжелее меди.
История развития представлений о металлах
См. также: История производства и использования железа
Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы, значительно распространенные в природе и легко выделяемые из их соединений: олово, свинец, железо и ртуть. Эти семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к эпохе, удаленной на 3000—4000 лет от н. э.
К семи известным металлам уже только в средние века прибавились цинк, висмут, сурьма и в начале XVIII столетия мышьяк. С середины XVIII века число открытых металлов быстро возрастает и к началу XX столетия доходит до 65, а к началу XXI века — до 96.
Ни одно из химических производств не способствовало столько развитию химических знаний, как процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на их натуру в более или менее определенной форме появляются только в средние века у алхимиков. Правда, идеи Аристотеля о природе: образования всего существующего из четырёх элементов (огня, земли, воды и воздуха) уже тем самым указывали на сложность металлов; но эти идеи были слишком туманны и абстрактны. У алхимиков понятие о сложности металлов и, как результат этого, вера в возможность превращать одни металлы в другие, создавать их искусственно, является основным понятием их миросозерцания.
Лишь Лавуазье выяснил роль воздуха при горении и показал, что прибыль в весе металлов при обжигании происходит от присоединения к металлам кислорода из воздуха, и таким образом установил, что акт горения металлов есть не распадение на элементы, а, напротив, акт соединения, вопрос о сложности металлов был решен отрицательно. Металлы были отнесены к простым химическим элементам, в силу основной идеи Лавуазье, что простые тела суть те, из которых не удалось выделить других тел. С созданием периодической системы химических элементов Менделеевым элементы металлов заняли в ней своё законное место.
Металлы: виды и свойства
Большинство элементов можно рассматривать как металлы. Они сгруппированы в середине в левой стороне таблицы. Металлы бывают щелочные, щелочноземельные, переходные, лантаноиды и актиниды.

Все они имеют несколько общих свойств, это:
- твердое вещество при комнатной температуре (за исключением ртути);
- обычно блестящее;
- с высокой температурой плавления;
- хороший проводник тепла и электричества;
- с низкой способностью к ионизации;
- с низкой электроотрицательностью;
- податливый (способный принимать заданную форму);
- пластичный (можно вытянуть в проволоку);
- с высокой плотностью;
- вещество, которое теряет электроны в реакциях.
Список металлов, известных науке
- литий;
- бериллий;
- натрий;
- магний;
- алюминий;
- калий;
- кальций;
- скандий;
- титан;
- ванадий;
- хром;
- марганец;
- железо;
- кобальт;
- никель;
- медь;
- цинк;
- галлий;
- рубидий;
- стронций;
- иттрий;
- цирконий;
- ниобий;
- молибден;
- технеций;
- рутений;
- родий;
- палладий;
- серебро;
- кадмий;
- индий;
- коперниций;
- цезий;
- барий;
- олово;
- железо;
- висмут;
- свинец;
- ртуть;
- вольфрам;
- золото;
- платина;
- осмий;
- гафний;
- германий;
- иридий;
- ниобий;
- рений;
- сурьма;
- таллий;
- тантал;
- франций;
- ливерморий.

Всего известно около 105 химических элементов, большая часть из которых — металлы. Последние являются очень распространенным элементом в природе, который встречается как в чистом виде, так и в составе всевозможных соединений.

Металлы залегают в недрах земли, их можно найти в различных водоемах, в составе тел животных и человека, в растениях и даже в атмосфере. В периодической системе они располагаются начиная с лития (металл с формулой Li) и заканчивая ливерморием (Lv). Таблица она продолжает пополняться новыми элементами, и в основном это металлы.
Нахождение в природе
Металлы широко распространены на нашей планете. В виде солей и соединений они содержатся в морской воде. Больше всего она полна магнием (0,12%) и кальцием (1,05%). В земной коре самый распространенный металл – это алюминий. Он составляет примерно 8% всей ее массы. В ней также содержится много железа (4,1%), кальция (4%), натрия (2,3%), магния (2,3%), калия (2,1%).

Но металлы присутствуют не только во внешней среде. Они присутствуют в любом живом организме, отвечая за многие жизненно важные функции. В человеческом теле содержится около 3% металлов. Железо в крови помогает гемоглобинам присоединять кислород и осуществлять обмен с углекислым газом. Магний есть в мышцах и нервной системе. Он участвует в синтезе белков, отвечает за расслабление мышц, тормозит возбуждение нервных окончаний.
Самые необходимые для нас: магний, железо, натрий, кальций, калий, цинк, медь, кобальт, марганец и молибден. Металлы содержатся в костях, в мозге, в тканях других органов. Мы получаем их с водой и продуктами питания, и постоянно нуждаемся в пополнении их запасов. При дефиците этих элементов организм работает неправильно, правда, их избыток тоже не на пользу.









