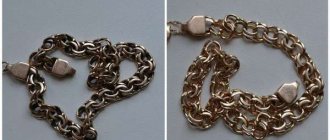Уникальные химические свойства золота обеспечили ему особое место в ряду металлов, используемых на Земле. Золото известно человечеству с древнейших времен. Его издревле использовали в качестве украшений, алхимики пытались вывести драгоценный металл из других менее благородных веществ. В настоящее время спрос на него только растет. Его используют в промышленности, медицине, технике. Кроме того, его приобретают и государства, и частные лица, используя в качестве инвестиционного металла.
Химические свойства «короля металлов»
Для обозначения золота используется знак Au. Это сокращение от латинского наименования металла — Aurum. В периодической системе Менделеева оно находится под номером 79 и располагается в 11 группе. По внешнему виду это металл желтого цвета. Золото находится в одной группе с медью, серебром и рентгением, но его хим свойства ближе к металлам платиновой группы.
Инертность — ключевое свойство этого химического элемента, которая возможна благодаря высокому значению электродного потенциала. При стандартных условиях золото не взаимодействует ни с чем, за исключением ртути. С ней этот химический элемент образует амальгаму, которая легко распадается при нагревании всего в 750 градусов по Цельсию.
Хим свойства элемента таковы, что остальные соединения с ним тоже недолговечны. Это свойство активно используется в добыче благородного металла. Существенно реакционность золота возрастает только при интенсивном нагревании. Например, его можно растворить в хлорной или бромной воде, спиртовом растворе йода и, конечно, в царской водке — смеси соляной и азотной кислоты в определенной пропорции. Химическая формула реакции такого соединения: 4HCl + HNO3 + Au = H (AuCl4) + NO + 2H2.
Химия золота такова, что при нагревании оно может взаимодействовать с галогенами. Чтобы образовать соли золота, надо восстановить этот химический элемент из кислотного раствора. При этом соли не выпадут в осадок, а растворятся в жидкость, образуя коллоидные растворы различного цвета.
Несмотря на то что золото не вступает в активные химические реакции с веществами, в быту не стоит допускать взаимодействия изделий из него с ртутью, хлором и йодом. Различная бытовая химия тоже не лучший сосед для изделий из драгоценного металла.
Дело в том, что в ювелирных украшениях используется сплав золота с другими металлами, и различные вещества, взаимодействуя с этими примесями, могут нанести красоте изделия непоправимый ущерб. Если нагреть золото выше 100 градусов по Цельсию, то на его поверхности появится окисная пленка толщиной в одну миллионную долю миллиметра.
Фальсификаторы
Всеобщее увлечение алхимией породило великое множество обманщиков. Для обмана использовались различные способы. Например, для демонстрации превращения свинца в золото брали золотой слиток, предварительно покрытый свинцом. При нагревании свинец расплавлялся и обнажал чистое золото! Иногда устраивали тигли с двойным дном. Или прятали кусочки золота в деревянные палочки, которыми помешивали расплавленный свинец или ртуть. Золото, появившееся в расплавах, доказывало факт превращения. Алхимика, уличённого в обмане, обычно вешали как фальшивомонетчика — на позолоченной виселице и в балахоне, усыпанном блёстками. Если же алхимик не был уличён в обмане, считалось, что он действительно обладает тайной — философского камня-, и тогда его ожидал застенок. Это был замкнутый круг, из которого невозможно было выбраться живым. Поэтому для занятий алхимией требовалось немалое мужество.
Другие особенности драгоценного металла
Золото — один из самых тяжелых известных металлов. Его плотность равна 19,3 г/cм3. Слиток весом в 1 килограмм имеет совсем небольшие размеры, 8х4х1,8 сантиметров. Именно таков стандартный размер банковского золотого слитка этого веса. Он сопоставим с размером обычной кредитной карты, правда, слиток немного толще.
Тяжелее, чем золото, только несколько химических элементов: плутоний, осмий, иридий, платина и рений. Но их содержание в земной коре, даже вместе взятых, намного меньше, чем этого драгоценного металла. При этом плутоний (химический знак Pu, не путать с Pt — это знак платины) — радиоактивный элемент.

Химический состав золота обеспечивает его физические свойства. Так, к основным свойствам этого металла, делающим его уникальным, относится:
- Ковкость, пластичность, тягучесть. Его очень легко расплющить или вытянуть. Так, из всего одного грамма золота можно получить проволоку длиной в 3 километра, а площадь тонких листов, полученных из 1 килограмма, составит 530 квадратных метров. Сверхтонкие листы из золотой фольги получили название «сусального золота». Им покрывают, к примеру, церковные купола и внутреннее убранство дворцов. Благодаря пластичности малым количеством желтого металла можно покрыть гигантские площади.
- Мягкость. Золото высокой пробы мягко настолько, что его легко поцарапать даже ногтем. Именно поэтому слитки в банках продаются в герметичных пластиковых упаковках. Если на нем будет замечена хоть одна маленькая царапина, то он будет признан бракованным. Для того чтобы сделать золото более прочным, при изготовлении изделий в него добавляют другие металлы. Это свойство обеспечило высокую популярность короля металлов в ювелирной промышленности.
- Высокая электропроводность. За счет этого хим свойства золото высоко ценится в электротехнике и промышленности. Лучше него электричество проводит только серебро и медь. При этом золото почти не нагревается: по теплопроводности выше него алмаз, серебро и медь. Вместе с таким свойством, как устойчивость к окислению, золото — идеальное вещество для изготовления полупроводников.
- Отражение инфракрасного света. Тончайшее золотое напыление, нанесенное на стекло, не пропускает инфракрасное излучение, оставляя видимую часть спектра. Это свойство активно применяется в космонавтике, когда нужно защитить глаза космонавтов от пагубного солнечного воздействия. Зачастую напыление применяют и в зеркальной системе высотных зданий, чтобы снизить расходы на охлаждение помещений.
- Устойчивость к коррозии и окислению. Слитки, которые хранятся в соответствии с правилами, даже при взаимодействии с воздухом практически не подвержены никакому химическому влиянию. Так что большая сохранность золота обеспечила его высокую популярность.
Метод добычи золота
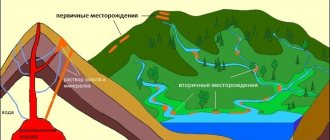
Золото является довольно редким элементом на Земле. Его содержание в земной коре невелико. В основном оно встречается в виде россыпей в самородном состоянии или в виде руды и изредка встречается в виде минералов. Иногда золото добывается в качестве сопутствующего вещества при разработке медных или полиметаллических руд.
Способов добычи этого благородного металла человечество знает множество. Самый простой — отмучивание, то есть отделение золотой руды от пустой породы по специальному техпроцессу. Однако этот способ предполагает большие потери, так как технология далеко не совершенна. На смену механическому способу добычи золотой руды пришла химия. Алхимики, а после них химики получили множество способов выделения искомого металла из породы, среди них самые распространенные:
- амальгамация;
- цианирование;
- электролиз.
Электролиз, открытый в 1896 году Э. Вольвиллом, получил широкое распространение в промышленности. Его суть заключается в том, что аноды, состоящие из золотосодержащего вещества, помещаются в ванную с солянокислым раствором. В качестве катода используется лист из чистого золота. В процессе электролиза (пропускание тока через катод и анод) на катоде откладывается искомое вещество, а все примеси выпадают в осадок. Таким образом хим свойства драгоценного металла помогают получать его в промышленных масштабах практически без потерь.
Эдисон. Тесла и другие
Великий Эдисон и загадочный Никола Тесла тоже не избежали соблазна поисков — философского камня». Многие дни, уединившись в своей лаборатории, они предавались никому не известным занятиям. Дабы уберечься от досужего любопытства фанатиков, исследователи тщательно зашторивали окна лаборатории, а когда уходили. Эдисон самолично проверял замки на дверях. В надежде на ожидаемый результат они, в частности, облучали тонкие пластинки серебра при помощи рентгеновского аппарата с золотыми электродами. Но удача пришла к профессиональному химику Стефену Эмменсу, кстати, автору изобретения взрывчатого вещества для мин — «эмменсита». Он сообщил представителям прессы, что открыл способ превращения серебра в некий металл, практически не отличимый от золота! Как ни странно, но три слитка этого металла после лабораторных проверок были куплены золотых дел мастерами по цене реального золота! Последнее, что можно сказать о Стефене Эмменсе, это о его согласии выступить с публичной демонстрацией своих опытов на Всемирной выставке в Париже в 1900 году. Но он так и не появился там, и вообще исчез без следа! Подобная судьба постигла и немецкого профессора Адольфа Миетхе, объявившего в 1924 году об изобретении им метода превращения ртути в золото. Пользуясь этим методом, профессор якобы неоднократно получал в своей лаборатории чистое золото!
Сплавы с другими металлами
Сплавы благородного металла образуются с двумя целями:
- Изменить механические свойства золота, сделать его более прочным или, напротив, более хрупким и ковким.
- Сэкономить запасы драгоценного металла.
Различные добавки в золото называются лигатурой. Цвет и свойства сплава зависят от того, какова химическая формула его составляющих. Так, серебро и медь значительно повышают твердость сплава, что позволяет использовать его для изготовления ювелирных изделий. А вот свинец, платина, кадмий, висмут и некоторые другие хим элементы делают сплав более хрупким. Несмотря на это, их часто используют для производства самых дорогих украшений, так как они существенно изменяют цвет изделия. Самые распространенные сплавы:

- зеленое золото — сплав 75% золота, 20% серебра и 5% индия;
- белое золото — сплав золота и платины (в соотношении 47:1) или золота, палладия и серебра в пропорции 15:4:1.
- красное золото — сплав золота (78%) и алюминия (22%);
- сплав золота и серебра в пропорции 3:1 (что интересно, сплав в любой другой пропорции приобретет белый цвет, и эти сплавы называются общим термином «электрон»).
В зависимости от количества золота в сплаве, определяют его пробу. Она измеряется в промилле и обозначается трехзначной цифрой. Количество искомого металла в каждом сплаве строго регулируется государством. В России официально приняты только 5 проб: 375, 500, 585, 750, 958, 999. Цифры пробы означают, что именно столько мер золота приходится на 1000 мер сплава.
Иными словами, в слитке или изделии 585 пробы содержится 58,5% золота. Золото высшей пробы, 999, считается чистым. Его для своих нужд использует только химия, так как этот металл слишком хрупкий и мягкий. 750 проба — самая популярная в ювелирной промышленности. Ее основные компоненты — серебро, медь, платина. На изделии обязательно должно стоять клеймо — цифровой знак, обозначающий пробу.
ЗОЛОТО
ЗОЛОТО (Aurum) Au, хим. элемент I гр. периодич. системы, ат. н. 79, ат. м. 196,9665; относится к благородным металлам. В природе один стабильный изотоп 197Аu. Конфигурация внеш. электронной оболочки 5d106s1; степени окисления +1, +3, редко +5; энергии ионизации Аu0 : Аи+ : Аu2+ : Аu3+ соотв. равны 9,2258, 20,5 и 30,5 эВ; электроотрицательность по Полингу 2,4 сродство к электрону 2,8 эВ; атомный радиус 0,144 нм, ионные радиусы (в скобках указаны координац. числа) Аu+ 0,151 нм (6), Аu3+ 0,082 нм (4), 0,099 нм (6). Содержание золота в земной коре 4,3-10 % по массе, в воде морей и океанов менее 5.10-6 мг/л. Относится к рассеянным элементам. Известно более 20 минералов, из к-рых главный — самородное золото (электрум, медистое, палладистое, висмутистое золото и др.), представляющее собой твердый р-р Ag (от следов до 43%) в золоте и содержащее также Сu, Fе, Рb, реже — металлы платиновой группы, Mn, Bi и др. Хим. соединения золота в природе редки, в осн. это теллуриды — калаверит АuТе2, креннерит (Au,Ag)Te2, сильванит AuAgTe4, петцит Ag3AuTe2, мутманнит (Ag,Au)Te, монтбрейит Аu2Те3 и др. Золото присутствует гл. обр. в кварце, карбонатах, пирите, арсенопирите, галените, сфалерите, халькопирите. В рудах золото присутствует в виде вкраплений размерами б. ч. 0,1-1000 мкм, иногда находят самородки до неск. десятков кг. Генетич. типы пром. месторождений золота: гидротермальные высокотемпературные золото-арсенопиритовой формации; гидротермальные среднетемпературные кварц-сульфидной и золото-кварцевой формаций; гидротермальные низкотемпературные золото-серебряной формации; месторождения выветривания и метаморфизованные; аллювиальные россыпи. Золото извлекают из собственно золотых руд и, попутно, из железных, медных, свинцово-цинковых и урановых руд. Мировые пром. ресурсы золота (без СССР) ок. 65 тыс. т. Свойства.
Золото — желтый металл; кристаллич. решетка гранецентрир. кубическая, а = 0,40786 нм, z = 4, пространств. группа Fm3m. Т. пл. 1064,4 °С, т. кип. 2880 °С; плотн. твердого золота 19,32 г/см3, жидкого 17,22 г/см3 (1100°С); С0p 25,39 Дж/(моль.К); DH0пл 12,55 кДж/моль,DH0исп 348 кДж/моль; S0298 47,40 Дж/(моль.К); ур-ния температурной зависимости давления пара: для твердого золота lgp (гПа) = 3,94 — 19820/T — 0,3061gT — 0,16.10-3 Т (298-1337 Т), для жидкого lgp(Пa) = 10,710 + 17866/Т (1337-3150 К); температурные коэф. линейного расширения (5,98-19,10).10-6 К-1 (40-1200 К), объемного (1,79-5,73).10-5 К-1 (40-1200 К); теплопроводность 318 Вт/(м.К) при 273 К; r (2,06-2,84).10-8 Ом.м (273-373 К), температурный коэф. r 4,0.10-3 К-1 (273-373 К); диамагнетик, магн. восприимчивость —29,59.10-6. Золото — очень мягкий и пластичный металл, твердость по Моосу ~ 2,5, по Бринеллю 220-250 МПа; модуль упругости 81 ГПа; sраст 10-25 МПа. Золото устойчиво на воздухе и в воде; с О2, Н2, N2, P, Sb и С непосредственно не взаимодействует. Фосфид Аu2Р3 (DH0обр -102 кДж/моль) и антимонид AuSb2 (DH0обр — 13 кДж/моль) получают косвенным путем. Золото не раств. в р-рах щелочей и к-тах, раств. в горячей H2SeO4, смесях к-т — Н2SО4 с HNO3, H2SO4 с НМnО4, а также в царской водке (НСl + НNO3): Аu + HNO3 + 4НСl : H[AuCl4] + NO + 2Н2О; после осторожного выпаривания выделяются желтые кристаллы комплексной золотохлористоводородной к-ты НАuСl4.3Н2О. В водных р-рах цианидов (Na, Ca, К) при доступе О2 или др. окислителей золото раств. с образованием дицианоаурат-иона (цианирование): 2Au + 4CN- + Н2О + 0,5О2 : 2[Au(CN)2]- + 2OH-, что лежит в основе важнейшего пром. способа извлечения золота из руд. С галогенами в отсутствие влаги золото без нагревания не взаимод., при нагр. порошка золота в атмосфере галогенов образуются золота галогениды. С мн. металлами золото дает сплавы. На легком образовании амальгамы золота основан один из методов извлечения золота из горных пород. Соед. золота неустойчивы, в водных р-рах гидролизуются, легко восстанавливаются до металла. В табл. 1 приведены значения стандартных окислит.-восстановит. потенциалов E0 нек-рых соед. AuLn (где L — лиганд, п = 1,3). Важнейшим соед. золота посвящены отдельные статьи [см. Золота цианиды, Золотоорганические соединения, Калия дицианоаурат(I)], ниже приводятся сведения о др. соединениях золота. Гидроксид Au(OH)3 — темно-коричневые кристаллы; при нагр. дегидратируется с образованием сначала АuО(ОН), а затем сесквиоксида Аu2О3, к-рый выше 160°С разлагается на золото и О2; р-римость в воде 2,4.10-12моль/л при 20 °С, в р-рах НNО3 — до 0,38 моль/л при 25 °С, в р-рах NaOH — до 8.10-4моль/л при 25°С. В последнем случае в р-ре золото находится в виде гидроксоаурат-ионов [Аu(ОН)4]- (рН 7-13). Образуется Аu(ОН)3 при добавлении конц. р-ра щелочи или Mg(OH)2 к р-рам Н[АuСl4]. Ауpaты неустойчивы, легко разлагаются при нагревании. Аураты щелочных металлов хорошо раств. в воде, р-римость растет с увеличением ионного радиуса катиона; аураты Mg, Ca, Sr, Ba, Тl(I) ограниченно растворимы. Аураты с нек-рыми орг. в-вами образуют взрывчатые смеси. Предполагают, что при действии на гидроксид золота р-ров щелочи образуются аурат-анионы [Н2АuО3]-, [HAuO3]2-, [AuO3]3-. См. также табл. 2. Др. кислородные соед. золота неустойчивы, легко образуют взрывчатые смеси. Соед. Аu2О3 с аммиаком Au2O3·4NH3 наз. «гремучим золотом»; взрывается при 145°С, иногда и при более низких т-рах; без взрыва раств. в р-рах цианидов щелочных металлов. Гемисульфид золота Au2S — черно-коричневые кристаллы; DG0обр 29 кДж/моль; плохо раств. в воде (произведение р-римости 4.10-69 при 25 °С), раств. в р-рах цианидов и полисульфидов щелочных металлов. Получают взаимод. конц. р-ра K[Au(CN)2] с H2S с послед. нагреванием до кипения с избытком соляной к-ты. Сесквисульфид Au2S3 — черные кристаллы; разлагается при нагр. до 200 °С; не раств. в соляной и серной к-тах, раств. в HNO3 с выделением элементарного золота, р-рах KCN, бромной воде. Получают взаимод. H2S с АuСl3 или комплексными хлоридами золота в безводном эфире на холоду. Известны комплексные соед., содержащие анионы [AuS3]2-, [AuS2]-, [AuS]-, [Au(SO3)2]3-, [Au(S2O3)2]3- . Моноселенид AuSe существует в двух кристаллич. модификациях моноклинной сингонии. При обработке солянокислых р-ров золота на холоду селеноводородом осаждается сесквиселенид Au2Se3·H2Se, устойчивый (после сушки) в интервале 40-390°С; при 535-650°C разлагается с выделением элементарного золота. Селенат (IV) Au2(SeO3)3·3H2SeO3 лимонно-желтые кристаллы; не раств. в воде, раств. в соляной и селенистой (при нагр.) к-тах. Селенат (VI) Au2(SeO4)3 желтые кристаллы; DH0обр — 954 кДж/моль; не раств. в воде, разлагается соляной к-той, раств. в H2SO4, HNO3 и горячей конц. H2Se04. Теллурид (гемителлурид) АuТе2 — кристаллы от латунно-желтого до серебристо-белого цвета с металлич. блеском; плотн. 9,3 г/см, DH0обр — 11 кДж/моль; хрупок, твердость по Моосу 2,5-3. Тиоцианат AuSCN — бесцв. кристаллы; не раств. в воде и орг. р-рителях; при 140°С разлагается до металлич. золота и (SCN)n; под действием воды образует в р-рах прочные комплексные анионы [Au(SCN)2]- и [Au(SCN)4]- . Коллоидное золото. При восстановлении золота в разб. р-рах его солей, а также при электрич. распылении золота в воде образуются коллоидные р-ры золота, окраска к-рых зависит от степени дисперсности частиц, а интенсивность окраски от их концентрации. Частицы золота в коллоидном р-ре отрицательно заряжены. Гидрофобный золь золота в солянокислом водном растворе можно представить схемой: [Аu]m — ядро мицеллы (число атомов т в зависимости от условий может меняться от неск. сотен до миллионов единиц); АuСl4- — ионы, определяющие отрицательный заряд коллоидной частицы золота и величину потенциала адсорбц. слоя толщиной d0; Н+ — противоионы, определяющие потенциал диффузионного слоя (электрокинетич. потенциал), из к-рых х ионов находится в размытой части двойного слоя толщиной d; n — кол-во ионов АuСl4-, адсорбированных на пов-сти ядра мицеллы, при этом п << т.
Получение.
Источники золота — руды и пески собственно золотых россыпных и коренных месторождений (содержание золота в них 5-15 г/т), а также промежут. продукты (0,5-3 г/т) свинцово-цинкового, медного, уранового и нек-рых др. произ-в. Из россыпей золота извлекают гравитац. методами, используя т. н. ловушки, отсадочные машины, концентрац. смолы, шлюзы, разл. промывочные приборы. Со дна рек и озер золотоносные пески добывают и обогащают на драгах. При извлечении золота из коренных руд используют комбинир. схемы, включающие обогатительные (гравитация, флотация) и металлургические (выщелачивание, ионообменная сорбция из пульп, цианирование, реже амальгамирование) операции. При использовании цианирования измельченную руду или концентрат обрабатывают р-ром NaCN при перемешивании; из цианистых р-ров золото осаждают порошком Zn, с помощью ионообменных смол или активир. углей. Конечные продукты схемы — обычно гравитационный концентрат (т. н. золотая головка) и черновое золото. Очищают золото растворением в царской водке с послед. избират. осаждением (напр., с помощью FeSO4), хлорированием в расплаве или р-ре (хлоринация) и электролитич. рафинированием в солянокислом р-ре.
Определение.
Качественно золото обнаруживают по образованию окрашенных осадков и р-ров. Используют р-ции соед. золота с Hg2Cl2, H2O2, SnCl2, K4[Fe(CN)6], KI, бснзидином, 1-нафтиламином, о-толуидином, гваяковой смолой, комплексоном III, аскорбиновой к-той, фенилтиомочевиной, дитизоном, родамином, изохинолином и др. Можно использовать сорбцию на ионообменных смолах, а также методы электрофореза, хроматографии (круговой тoнкослойной, осадительной и распределительной), люминесценции. Количественно золото определяют гравиметрически (в виде металлич. золота), титриметрически (восстановлением Аu3+ с послед. титрованием избытка восстановителя), фотометрически (по оранжевой окраске бромаурат-иона, а также по интенсивной окраске соед. золота с разл. орг. реагентами), электрохимически, спектральными методами, методами активац., атомно-абсорбц. и пробирного анализов. Для предварит. концентрирования золота используют хим. методы, жидкостную экстракцию и хроматографию.
Применение.
Золото — валютный металл, выполняет ф-цию всеобщего эквивалента денег. Золото и его сплавы используют для декоративных целей, изготовления ювелирных изделий, монет, медалей, зубных протезов, деталей хим. аппаратуры, электрич. контактов и проводов, изделий микроэлектроники, для плакирования труб в хим. пром-сти, в произ-ве припоев, катализаторов, часов, для окрашивания стекол, изготовления перьев для авторучек, нанесения покрытий на металлич. пов-сти (в самолетостроении, космич. технике и др. областях). Искусств. радиоактивный изотоп 198Аu (T1/2 2,967 сут) используют для лечения опухолей в радиотерапии. Мировое произ-во золота (без СССР) ок. 1100 т/год (1984). Осн. производители — ЮАР, СССР, Канада, США, Бразилия, Австралия. Нек-рые препараты Au(I) токсичны, накапливаются в почках, в меньшей мере — в печени, селезенке и гипоталамусе; накопление золота в почках может привести к их заболеванию, а также к дерматитам, стоматитам, тромбоцитопении. Золото было известно человеку уже в древнейшие времена; возможно, что оно явилось первым металлом, к-рый человечество стало применять для своих потребностей. Имеются данные о добыче золота и изготовлении из него разл. изделий в Египте (4100-3900 до н. э.), Индии, Индокитае (2000-1500 до н. э.) и др. === Исп. литература для статьи
«ЗОЛОТО»: Бусев А. И., Иванов В. М., Аналитическая химия золота, М., 1973; Малышев В. М., Румянцев Д. В., Золото, М., 1979; Паддефет Р., Химия золота, пер. с англ., М., 1982; Благородные металлы. Справочник, под ред. Е. М. Савицкого, М., 1984; Марфунин А. С., История золота, М., 1987. B. C. Стрижко, М. А. Меретуков.
Страница «ЗОЛОТО» подготовлена по материалам химической энциклопедии.
Еще по теме:
- Золото — справочник по веществам
Фальсификация украшений из золота
Если что-то хорошо продается, это знак того, что можно что-то подделать под это. Фальсификации под золото, пожалуй, одна из самых распространенных мошеннических схем на сегодняшний день, что обеспечивается высокой стоимостью драгоценного металла. Чаще всего подделывают «белое золото», выдавая за сплав с платиной обыкновенное серебро высокой пробы. Но опытный покупатель всегда отличит один драгоценный металл от другого.
Идеален для подделки золота другой хим элемент — вольфрам. Из него изготавливают волоски лампочек, электроды и так далее. Этот химический элемент имеет сходную с золотом плотность, поэтому по весу практически не отличим от благородного металла.
Кроме того, иногда подделывают знак пробы. Если есть сомнения относительно качества изделия или если клеймо с пробой не совпадает с цифрой пробы, указанной в сопроводительных документах, лучше отказаться от приобретения такого изделия.
Как отличить подделку?
Есть несколько способов, как отличить подлинное изделие от фальсификации. Надо отметить, что применение только одного теста не гарантирует точность результата. Лучше вести проверку по нескольким параметрам. Итак, опытные ювелиры используют следующие способы, чтобы отличить золото от подделки:
- Проверяют мягкость. Настоящий желтый металл очень мягкий. Если надкусить его, то на нем останется след. Именно так, на зуб, можно отличить подделку. Сплавы с минимальным содержанием благородного металла твердые.
- Проверяют звучание. Настоящее ювелирное изделие из золота звенит мягко, легко. Но только на слух полагаться не стоит. Различные примеси по-разному искажают звучание.
- Капают йодом. Если в изделии большая доля искомого металла, то капля йода, помещенная на поверхность предмета, почернеет. В противном случае — станет белой.
- Чертят по кафелю. Так как плотность золота выше кафеля, то оно должно оставить на нем характерный золотистый след. Если же это подделка, то след останется на изделии. Также следы золотой пыли останутся на коже, если изделие тщательно потереть, например, о руку.
- Взвешивают на специальных весах. Если плотность металла меньше заявленной, то и вес изделия будет меньше.
- Скребут по тыльной стороне предмета. Это делается для того, чтобы узнать, не скрывается ли под слоем позолоты обыкновенная медь или вольфрам.
Потенциального покупателя должны насторожить и следующие моменты:
- отсутствие документации;
- несоответствие клейма с пробой, задекларированной в документах;
- исправления в документах;
- стертое клеймо с пробой;
- знак пробы советского периода;
- непривычный цвет изделия.
Если смущает что-то непонятное и есть какие-то подозрения, это верный знак, что сперва изделие стоит показать профессионалу, оценщику или сотруднику ломбарда, и только потом принимать решение о покупке.