Нахождение в природе
Золото везде. Кубический километр морской воды содержит 5 кг вожделенного элемента, а если уколоть палец и выдавить каплю крови, в ней будет 0,00025 мг золота. 10 мг содержится в человеческом скелете: если задаться целью выплавить кольцо из людей, понадобится всего 300 человек. Но это золото находится в окружающей среде в настолько рассеянной форме, что извлекать его оттуда невыгодно, а часто и невозможно.
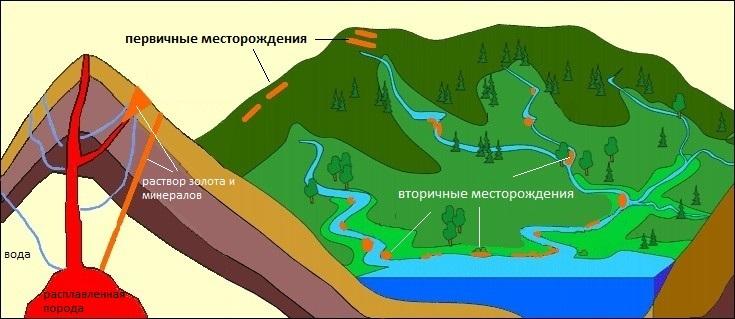
Месторождения, подходящие для добычи золота, подразделяются на коренные — первичные (постмагматические) и вторичные (россыпные).
Первичные месторождения
Химическим элементом Au богата магма — расплав внутри земного шара. Золото есть в верхних слоях мантии и частично в земной коре (впрочем, в ней содержится почти вся периодическая таблица). Магма выходит на поверхность планеты, остывает и превращается в твердую породу. Места, где она содержит столько драгоценного элемента, чтобы окупилась промышленная разработка, и есть коренные месторождения.
Природное золото находят в виде самородков — цельных зерен химически чистого вещества. Часто оно соединено с другими элементами (магма содержит почти все):
- серебром;
- медью;
- металлами платиновой группы;
- висмутом и другими.
Вторичные месторождения
Вторичные месторождения — итог разрушения первичных, так называемого выветривания, которое бывает:
- физическим (причина — ветер, вода, температурные колебания);
- химическим (химические реакции);
- биологическим (бактерии и другие организмы).
Россыпь чистого золота выглядит как песок и порой относится водами на много километров от коренного месторождения.
Золото в биосфере и в медицине
В биосфере золото мигрирует в комплексе с органическими соединениями и механическим путём в речных взвесях. 1 л морской и речной воды содержит около 4·10-9 г золота. На участках золоторудных месторождений подземные воды содержат золота приблизительно 10-6 г/л. Оно мигрирует в почвах и оттуда попадает в растения; некоторые из них концентрируют золото, например хвощи, кукуруза.
В медицине препараты золота используют в виде взвеси в масле (отечественный препарат кризанил, зарубежный — миокризин) или водорастворимых препаратов (зарубежные — санкризин и солганал) для инъекций при лечении хронических ревматических артритов, эритематозной красной волчанки, часто в сочетании с гормональными и др. препаратами. Препараты золота нередко вызывают побочные явления (повышение температуры тела, раздражение кишечника, почек и др.). Противопоказания к применению препаратов золота: тяжёлые формы туберкулёза, сахарный диабет, заболевания сердечно-сосудистой системы, печени, почек, крови. Радиоактивное золото (чаще 198Au) вводят в ткани в виде штифтов, гранул и т.п. — для гамма-терапии и в виде коллоидных растворов — для бета-терапии. Его применяют при лечении опухолей, обычно в сочетании с хирургическим и медикаментозным лечением, а также с диагностическими целями — в виде коллоидных растворов при исследовании ретикуло-эндотелиальной системы, печени, селезёнки и др. органов.
История открытия элемента
В чистом виде золото попало в руки человека в VI веке до нашей эры. Массовые разработки африканских месторождений начались раньше — около 2000 года до н. э., но методик избавления от примесей не было, и золотые изделия того времени имеют низкую пробу.
Во времена поздней античности (начало нашей эры) по миру начала распространяться алхимия с ее стремлением превращать недрагоценные химические элементы в благородные. Она не добилась успеха, но современная цивилизация благодаря ей владеет многими чудесами — например, техникой добычи химическичистого золота из руды.
Латинское название золота — Aurum (читается как аурум) — «желтый». Оно принято как интернациональное. Символ солнца у алхимиков выглядел как круг с точкой внутри, а в современной химии оно обозначается сокращением Au.
Извлечение золота
Источники золота — пески и руды собственно золотых россыпных и коренных месторождений (содержание золота в них 5-15 г/т), а также промежут. продукты (0,5-3 г/т) свинцово-цинкового, медного, уранового и нек-рых др. произ-в. Из россыпей золото извлекают гравитац. методами, используя т. н. ловушки, отсадочные машины, концентрац. смолы, шлюзы, разл. промывочные приборы. Со дна рек и озер золотоносные пески добывают и обогащают на драгах. При извлечении золота из коренных руд используют комбинир. схемы, включающие обогатительные (гравитация, флотация) и металлургические (выщелачивание, ионообменная сорбция из пульп, цианирование, реже амальгамирование) операции. При использовании цианирования измельченную руду или концентрат обрабатывают р-ром NaCN при перемешивании; из цианистых р-ров золото осаждают порошком Zn, с помощью ионообменных смол или активир. углей. Конечные продукты схемы — обычно гравитационный концентрат (т. н. золотая головка) и черновое золото. Очищают золото растворением в царской водке с послед. избират. осаждением (напр., с помощью FeSO4), хлорированием в расплаве или р-ре (хлоринация) и электролитич. рафинированием в солянокислом р-ре.
Получение золота и его аффинаж. Из россыпных месторождений золота можно извлечь отмучиванием, основанным на большой разности плотностей золота и пустой породы. Этот способ, применявшийся уже в глубокой древности, сопряжён с большими потерями. Он уступил место амальгамации (известной уже в 1 в. до н. э. и применявшейся в Америке начиная с 16 в.) и цианированию, получившему широкое распространение в Америке, Африке и Австралии в 1890-х гг. В конце 19 — начале 20 вв. основным источником золота стали коренные месторождения. Золотоносную породу сначала подвергают дроблению и обогащению. Из полученного концентрата извлекают золото раствором цианида калия или натрия. Из раствора комплексного цианида осаждают золото цинком; при этом выпадают и примеси. Для очистки (аффинажа) золота электролизом (способ Э. Вольвилла, 1896) аноды, отлитые из нечистого золота, подвешивают в ванне, содержащей солянокислый раствор AuC13, катодом служит лист чистого золота. При прохождении тока примеси выпадают в осадок (анодный ил, шлам), а на катоде отлагается золото чистотой не менее 99,99%.
Определение [идентификация в породах и минералах]. Качественно золото обнаруживают по образованию окрашенных осадков и р-ров. Используют р-ции соед. золота с Hg2Cl2, H2O2, SnCl2, K4[Fe(CN)6], KI, бснзидином, 1-нафтиламином, о-толуидином, гваяковой смолой, комплексоном III, аскорбиновой к-той, фенилтиомочевиной, дитизоном, родамином, изохинолином и др. Можно использовать сорбцию на ионообменных смолах, а также методы электрофореза, хроматографии (круговой тoнкослойной, осадительной и распределительной), люминесценции. Количественно золото определяют 1) гравиметрически (в виде металлического золота), 2) титриметрически (восстановлением Аu3+ с послед. титрованием избытка восстановителя), 3) фотометрически (по оранжевой окраске бромаурат-иона, а также по интенсивной окраске соед. 3. с разл. орг. реагентами), 4) электрохимически, спектральными методами, методами активац., атомно-абсорбц. и пробирного анализов. Для предварит. концентрирования золота используют химические методы, жидкостную экстракцию и хроматографию.
Как получают
Основные способы получения золота в промышленных масштабах дополняют друг друга — например, шлих можно очистить от плотных примесей путем амальгамации.
Промывка
Промывка (шлихование) — древний метод добычи золотого песка (шлиха) из вторичных месторождений. Песок отмывается благодаря плотности: менее плотные минералы вымываются водой, а шлих оседает.
Масштабная добыча золота автоматизирована: вместо людей работают промывочные устройства и экскаваторы. Однако принцип их действия за последние 2000 лет почти не изменился.
Шлих — не чистое золото. Существуют элементы плотнее — они оседают с песком на дне промывочной емкости. Для финальной очистки используются другие, в частности химические, способы.
Амальгамация
Этот метод тоже известен с древности, но описан в XVI веке. Он возможен благодаря свойству ртути образовывать сплавы (амальгамы) с другими металлами без дополнительного термического или химического воздействия. После избавления от фрагментов пустой породы химические элементы механически разделяются.
Мнение эксперта
Всеволод Козловский
6 лет в ювелирном деле. Знает все о пробах и может определить подделку за 12 секунд
Амальгамация применяется не везде: в ряде стран (с 1988 года — в России) запрещено использовать ртуть из-за смертельной опасности этого элемента для человека.
Цианирование
Способ извлечения драгоценного элемента из руды цианированием основывается на способности золота растворяться в синильной кислоте (цианистом водороде, HCN) и ее солях. Руда обрабатывается слабым (0,03–0,3 %) раствором цианида. Благородный металл реагирует раньше других химических элементов, а после химической реакции осаждается из раствора.
Белое золото: состав
Белым золотом называют золотые сплавы с палладием или платиной. Иногда, в состав белого золота могут входить оба эти металла в различных соотношениях. Самым прочным, красивым, но в тоже время и самым дорогим считается платиновое золото (сплав золота и платины). Процент содержания в сплаве чистого золота определяется пробой. Очень часто ювелирные изделия из белого золота сверху покрывают тонким слоем родия (родируют). Белое золото – это идеальная оправа для драгоценных камней, особенно бриллиантов.
Место золота в периодической таблице Менделеева
Элемент располагается в XI группе (подгруппа меди), VI периоде периодической таблицы химических элементов.
Атомный номер (зарядовое число) золота — 79. Это количество протонов в ядре атома, равное количеству электронов, вращающихся вокруг ядра. Атомная масса — суммарная масса протонов и нейтронов (ядра атома) — у золота равна 196,9665 а.е.м. (атомных единиц массы). Природное золото существует в виде химически устойчивого изотопа 197 Au. Все остальные нестабильны и возможны только в условиях ядерного реактора.

Формула
Своей химической формулы золото не имеет, поскольку существует в виде одноатомных молекул. Электронная конфигурация атома Au записывается как [Xe] 4f14 5d10 6s1 и обозначает точное распределение электронов по орбиталям.
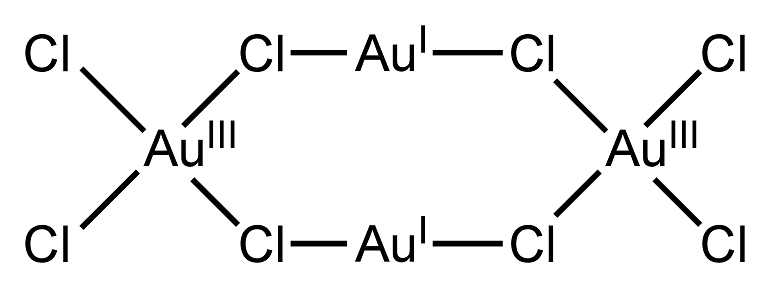
Взаимодействие с кислотами
В силу своей инертности (не абсолютной, но значительной) золото не растворяется в кислотах. Это позволяет использовать их для аффинажа (химической очистки элемента от примесей): сплав обрабатывается кислотой, например азотной, и так избавляется от лигатуры.
Но есть исключения. Чистое золото растворяют кислоты:
- селеновая;
- синильная и ее соли (цианиды);
- азотная в смеси с соляной (царская водка).
Степени окисления и связь с галогенами
В естественных условиях Au не окисляется под воздействием кислорода — это одно из свойств, делающих элемент драгоценным. При нагревании золото взаимодействует с галогенами (элементами XVII группы): йодом, фтором, бромом и хлором, образуя соответственно йодид, фторид, бромид и хлорид.
Стандартные степени окисления — 1 и 3. В лабораторных условиях выведен фторид со степенью окисления +5.
Химические свойства золота и его соединений
Конфигурация внешних электронов атома золота 5d10 6s1. В соединениях золото имеет валентности 1 и 3 (известны комплексные соединения, в которых золото 2-валентно).
Для золота характерна лёгкая восстановимость его из соединений до металла и способность к комплексообразованию. Существование закиси золота, т. е. оксида золота (I) Au2O — сомнительно.
С неметаллами (кроме галогенов) золото не взаимодействует. С галогенами золото образует галогениды, например 2Au + 3Cl2 =2AuC13. В смеси соляной и азотной кислот золото растворяется, образуя золотохлористоводородную кислоту H [AuCl4].
В растворах цианида натрия NaCN (или калия KCN) при одновременном доступе кислорода золото превращается в цианоаурат (I) натрия 2Na . Эта реакция, открытая в 1843 П. Р. Багратионом, получила практическое применение только в конце 19 в. (см. Цианирование).
Хлорид золота (I) AuCl получается при нагревании хлорида золота (III): AuC13 = AuCl + C12.
Хлорид золота (III) AuC13 получается действием хлора на порошок или тонкие листочки золота при 200 °С. Красные иглы AuCl3 дают с водой коричнево-красный раствор комплексной кислоты: AuC13 +Н2О=Н2[AuOC13].
При осаждении раствора AuC13 едкой щёлочью выпадает амфотерная жёлто-коричневая гидроокись золота(III) Au(OH)3 c преобладанием кислотных свойств; поэтому её называют золотой кислотой
, а её соли —
ауратами
(III). При нагревании гидроокись золота (III) превращается в окись золота Au2O3, которая выше 220° разлагается по реакции: 2Au2O3 = 4Au + 3O2.
При восстановлении солей золота хлоридом олова (II) 2AuC13 + 3SnCl2 = 3SnCl4 + 2Au образуется весьма стойкий пурпуровый коллоидный раствор золота (кассиев пурпур
); это используется в анализе для обнаружения золота. Количественное определение золота основано на его осаждении из водных растворов восстановителями (FeSO4, H2SO3, H2C2O4 и др.) или на применении пробирного анализа.
Гидроксид Au(OH)3 — темно-коричневые кристаллы; при нагревании дегидратируется с образованием сначала АuО(ОН), а затем сесквиоксида Аu2О3, к-рый выше 160°С разлагается на золото и О2; растворимость в воде 2,4.10-12 моль/л при 20°С, в р-рах НNО3 — до 0,38 моль/л при 25 °С, в растворах NaOH — до 8.10-4 моль/л при 25°С. В последнем случае в растворе золото находится в виде гидроксоаурат-ионов [Аu(ОН)4]- (рН 7-13). Образуется Аu(ОН)3 при добавлении концентрированного раствора щелочи или Mg(OH)2 к растворам Н[АuСl4].
Ауpaты неустойчивы, легко разлагаются при нагревании. Аураты щелочных металлов хорошо растворяются в воде, растворимость растет с увеличением ионного радиуса катиона; аураты Mg, Ca, Sr, Ba, Тl(I) ограниченно растворимы. Аураты с некоторыми органическими веществами образуют взрывчатые смеси. Предполагают, что при действии на гидроксид золота растворов щелочи образуются аурат-анионы [Н2АuО3]-, [HAuO3]2-, [AuO3]3-. См. также табл. 2.
Другие кислородные соединения золота неустойчивы, легко образуют взрывчатые смеси. Соединение Аu2О3 с аммиаком Au2O3.4NH3 называется «гремучим золотом»; взрывается при 145°С, иногда и при более низких температурах; без взрыва растворяется в растворах цианидов щелочных металлов.
Гемисульфид золота Au2S — черно-коричневые кристаллы; DG0обр 29 кДж/моль; плохо раств. в воде (произведение р-римости 4.10-69 при 25 °С), раств. в р-рах цианидов и полисульфидов щелочных металлов. Получают взаимод. конц. р-ра K[Au(CN)2] с H2S с послед. нагреванием до кипения с избытком соляной к-ты. Сесквисульфид Au2S3 — черные кристаллы; разлагается при нагр. до 200 °С; не раств. в соляной и серной к-тах, раств. в HNO3 с выделением элементарного золота, р-рах KCN, бромной воде. Получают взаимод. H2S с АuСl3 или комплексными хлоридами золота в безводном эфире на холоду. Известны комплексные соед., содержащие анионы [AuS3]2-, [AuS2]-, [AuS]-, [Au(SO3)2]3-, [Au(S2O3)2]3- .
Моноселенид AuSe существует в двух кристаллич. модификациях моноклинной сингонии. При обработке солянокислых р-ров золота на холоду селеноводородом осаждается сесквиселенид Au2Se3.H2Se, устойчивый (после сушки) в интервале 40-390°С; при 535-650°C разлагается с выделением элементарного золота.
Селенат (IV) Au2(SeO3)3.3H2SeO3 лимонно-желтые кристаллы; не раств. в воде, раств. в соляной и селенистой (при нагр.) к-тах.
Селенат (VI) Au2(SeO4)3 желтые кристаллы; DH0обр — 954 кДж/моль; не раств. в воде, разлагается соляной к-той, раств. в H2SO4, HNO3 и горячей конц. H2Se04.
Теллурид (гемителлурид) АuТе2 — кристаллы от латунно-желтого до серебристо-белого цвета с металлич. блеском; плотн. 9,3 г/см, DH0обр — 11 кДж/моль; хрупок, твердость по Моосу 2,5-3.
Тиоцианат AuSCN — бесцв. кристаллы; не раств. в воде и орг. р-рителях; при 140°С разлагается до металлич. золота и (SCN)n; под действием воды образует в р-рах прочные комплексные анионы [Au(SCN)2]- и [Au(SCN)4]- .
Коллоидное золото
При восстановлении золота в разб. р-рах его солей, а также при электрич. распылении золота в воде образуются коллоидные р-ры золота, окраска к-рых зависит от степени дисперсности частиц, а интенсивность окраски от их концентрации. Частицы золота в коллоидном р-ре отрицательно заряжены. Гидрофобный золь золота в солянокислом водном р-ре можно представить схемой:
[Аu]m — ядро мицеллы (число атомов т в зависимости от условий может меняться от неск. сотен до миллионов единиц); АuСl4- — ионы, определяющие отрицательный заряд коллоидной частицы золота и величину потенциала адсорбционного слоя толщиной d0; Н+ — противоионы, определяющие потенциал диффузионного слоя (электрокинетич. потенциал), из к-рых х ионов находится в размытой части двойного слоя толщиной d; n — кол-во ионов АuСl4-, адсорбированных на поверхности ядра мицеллы, при этом п
Меры чистоты золота
Государства контролируют оборот драгметалла. Век назад почти в каждой стране работала своя система пробирования, но сейчас большинство приведено к общему знаменателю.
Британская каратная система
В каратной системе (США, Канада, Швейцария) за 100 % принято число 24. Клеймо «18 K» говорит о том, что украшение состоит на 75 % из драгоценного металла, а на 25 % из чего-то ещё — например меди и палладия.

Метрическая система
В России, СНГ, Германии число на клейме — это количество промилле (тысячных долей) золота в сплаве. 500 ‰ — проба 500, 375 ‰ —375. Не существует только пробы 1000 — вместо нее 999,9. Она содержит микроскопическое количество примесей и условно считается чистой.
Золотниковая система
Золотниковая система проб действовала в Российской империи, РСФСР и СССР в 1798–1927 годах. Она основана на русском фунте, равном 96 золотникам, аналогична каратной математически, но делит целое не на 24, а на 96 долей.
Таблица соответствия проб
Посмотрим на три системы в сравнении. Существует также лотовая проба — она по сути повторяет каратную, но берет за сто процентов 16 единиц (лот). Лотовая проба использовалась для пробирования серебра в Европе до введения метрической системы и не имеет отношения к золоту.
| Метрическая система проб | 999 | 958 | 916 | 900 | 750 | 585 | 500 | 375 |
| Каратная система проб | 24 | 23 | 22 | 21,6 | 18 | 14 | 12 | 9 |
| Золотниковая система проб | 96 | 92 | 88 | 86,4 | 72 | 56 | 48 | 36 |
Золото в ноосфере (применение)
Золото — валютный металл, выполняет функцию всеобщего эквивалента денег. Золото и его сплавы используют для декоративных целей, изготовления ювелирных изделий, монет, медалей, зубных протезов, деталей химической аппаратуры, электрических контактов и проводов, изделий микроэлектроники, для плакирования труб в хим. пром-сти, в произ-ве припоев, катализаторов, часов, для окрашивания стекол, изготовления перьев для авторучек, нанесения покрытий на металлич. пов-сти (в самолетостроении, космич. технике и др. областях). Искусств. радиоактивный изотоп 198Аu (T1/2 2,967 сут) используют для лечения опухолей в радиотерапии. Мировое произ-во 3. (без СССР) ок. 1100 т/год (1984). Осн. производители — ЮАР, СССР, Канада, США, Бразилия, Австралия. Нек-рые препараты Au(I) токсичны, накапливаются в почках, в меньшей мере — в печени, селезенке и гипоталамусе; накопление золота в почках может привести к их заболеванию, а также к дерматитам, стоматитам, тромбоцитопении. Золото было известно человеку уже в древнейшие времена; возможно, что оно явилось первым металлом, к-рый человечество стало применять для своих потребностей. Имеются данные о добыче золота и изготовлении из него разл. изделий в Египте (4100-3900 до н. э.), Индии, Индокитае (2000-1500 до н. э.) и др.
Золото в технике
В технике золото применяют в виде сплавов с др. металлами, что повышает прочность и твёрдость золота и позволяет экономить его (см. Золотые сплавы). Содержание золота в сплавах, применяемых для изготовления ювелирных изделий, монет, медалей, полуфабрикатов зубопротезного производства и т.д., выражают пробой (см. Проба благородных металлов, Ювелирные сплавы); обычно добавкой служит медь (т. н. лигатура). В сплаве с платиной золото используется в производстве химически стойкой аппаратуры, в сплаве с платиной и серебром — в электротехнике. Соединения золота используют в фотографии (тонирование).
Золото в экономике
Золото в условиях товарного производства выполняет функцию всеобщего эквивалента (денег). Выражая стоимость всех др. товаров, золото в качестве всеобщего эквивалента приобретает особую потребительную стоимость, становится деньгами. Товарный мир выделил золото в качестве денег потому, что оно обладает наилучшими для денежного товара физическими и химическими свойствами: однородностью, делимостью, сохраняемостью, портативностью (большой стоимостью при небольших объёме и весе), легко поддаётся обработке. Значительное количество золота применяется для изготовления монет или в форме слитков хранится в качестве золотого запаса центральных банков (государства). Золото широко используется для промышленного потребления (в радиоэлектронике, приборостроении и др. прогрессивных отраслях), а также как материал для изготовления ювелирных изделий.
Размеры запасов золота — важный показатель устойчивости капиталистических валют и экономического потенциала отдельных стран. Купля-продажа золота для промышленного потребления, а также и для частной тезаврации (накопления) осуществляется на специальных рынках золота (см. Рынки золота). Выпадение золота из свободного межгосударственного рыночного оборота вызвало сокращение его доли в валютной системе капиталистического мира и, прежде всего, в валютных резервах капиталистических стран (с 89% в 1913 до 71% в 1928, 69% в 1958 и 55% в 1969). Всё более значительная часть вновь добываемого золота поступает для тезаврации и промышленного использования (в современной химической промышленности, для ракетостроения, космической техники). Так, за 1960—70 частная тезаврация золота возросла в 3,3 раза, его промышленное и ювелирное использование почти в 2,3 раза, золотые запасы капиталистических стран сохранились практически на одном уровне (41 млрд. долл.).
Золото в искусстве
Золото применяется с древнейших времён в ювелирном искусстве (украшения, культовая и дворцовая утварь и т.д.), а также для золочения. Благодаря своей мягкости, ковкости, способности тянуться золото поддаётся особо тонкой обработке чеканкой, литьём, гравировкой. Золото используют для создания разнообразных декоративных эффектов (от глади жёлтой полированной поверхности с плавными переливами световых бликов до сложных фактурных сопоставлений с богатой светотеневой игрой), а также для выполнения тончайшей филиграни. Золото, часто окрашенное примесями др. металлов в различные цвета, применяется в сочетании с драгоценными и поделочными камнями, жемчугом, эмалью, чернью.
Как отличить подделку
Чтобы навариться, выдав изделия из неблагородных сплавов за ценные, мошенники прибегают к уловкам: обжигают серебро на огне, соединяют медь с цинком и оловом. Обращайте внимание на:
- Клеймо — оно должно соответствовать стандарту.
- Цену — если она неправдоподобно низка, это тревожный знак.
- Страну-производитель — проверьте украшение лишний раз, если это Турция, Китай или ОАЭ.
Встречаются советы попробовать вещь на зуб при продавце или испытать химически, капнув на нее йодом. Это действенные для определения подлинности высоких проб способы, но они не всегда приемлемы в обществе. Если продавец вызывает у вас сомнения настолько, что вы готовы кусать его товар, стоит отказаться от покупки.
Сетевые новости о золоте
- Пикоразмерные кластеры золота ставят рекорды катализа.
- Создана совершенно новая форма золота. При очень высоком давлении у золота формируется иная структура на атомарном уровне. Кристаллическая структура золота довольно стойкая и напоминает октаэдр или куб. Поэтому его используют как своего рода стандарт в экспериментах с высоким давлением. Когда ученые быстро сжали золото при очень высоких температурах, оно сформировало т.н. объемно-центрированную кубическую решетку (ОЦК), атомы в которой «упакованы» менее эффективно.
Амальгамация
Ртуть при взаимодействии с золотом благодаря диффузии способна притягивать частицы драгоценного металла не растворяя её иа образовывая жидкий сплав, который называются амальгамой. Свойство ртути только смачивать золото забирая его в свою оболочку не входя в химическую реакцию было взято за основу в методе амальгации. Увлажнённую дробную породу смешивают с ртутью и оставляют на несколько часов для амальгации, а затем удаляют остатки шлака. Нагревая амальгаму отделяют ртуть от золота, получившийся шлам промывают и используют для дальнейшей обработки. Наибольший эффект достигается при максимально очищенных от масел и налетов золотых частиц, поэтому перед амальгацией желательно провести химическую и механическую очистку.
Регенерация
Покрытие позолотой разных ювелирных и бытовых изделий часто используются в ювелирной, часовой промышленности и медицине обработки золотом медицинского оборудования. На сегодняшний день в связи интенсивным роста выпуска электронной техники изготовители предъявлют повышенные требования к надежности готового оборудования. Принимая во внимание этот факт, многие детали покрывают золотом и поэтому объемы гальванических и химических покрытий во много раз увеличились.
Поэтому на многих ювелирных заводах и мастерских повышенное внимание пользуется регенерации (вывод) золота из отработанных растворов и электролитов. Так-же в связи увеличением сбыта лома радиотехнических деталей извлечение драгоценных металлов метедом регенерации имеет повышенный спрос.
← Аффинаж золота↑ Информация о золотеПлавка золота →